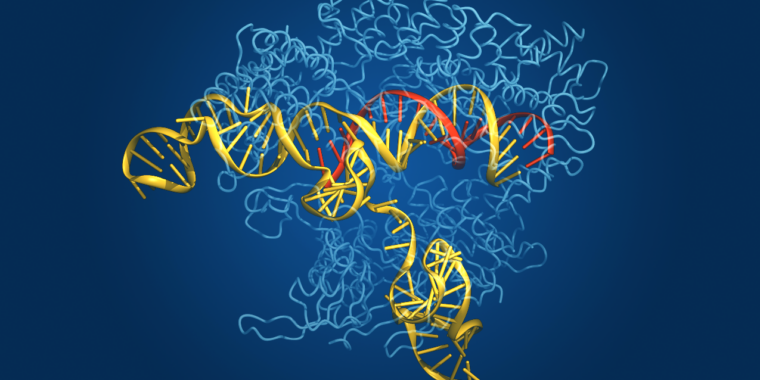
A CRISPR – a rendszeres, térközökben elhelyezkedő rövid palindrom ismétlődések csoportosulása – a mikrobiális világ válasza az adaptív immunitásra. A baktériumok nem termelnek antitesteket, amikor kórokozók támadják meg őket, majd blokkolják ezeket az antitesteket, ha újra találkoznak ugyanazzal a kórokozóval, mint mi. Ehelyett a kórokozó DNS-ének egy részét integrálják a genomjukba, és egy enzimhez kapcsolják, amivel felismerhetik a kórokozó DNS-szekvenciáját, és darabokra vághatják, ha a kórokozó újra megjelenik.
A vágást végző enzimet Cas-nak hívják, a CRISPR után. Bár a CRISPR-Cas rendszer bakteriális védekező mechanizmusként fejlődött ki, a kutatók a laboratóriumi vizsgálatok során a genetikai manipuláció hatékony eszközeként használták és adaptálták. Mezőgazdasági felhasználását is bebizonyította, és az Egyesült Királyságban engedélyezték az első CRISPR-alapú kezelést a sarlósejtes betegség és a transzfúziótól függő béta-talaszémia kezelésére.
A kutatók most egy új módszert fejlesztettek ki a CRISPR-Cas-szerű rendszerek genomjainak keresésére. Felfedezték, hogy sok további eszközzel dolgozhatunk.
DNS módosítás
A mai napig hatféle CRISPR-Cas rendszert azonosítottak különböző mikrobákban. Bár részleteiben különböznek egymástól, mindegyiknek ugyanaz a vonzereje: a fehérjéket a genetikai anyag egy meghatározott szekvenciájába juttatják olyan specifikussággal, amelyet eddig technikailag nehéz, költséges és időigényes volt elérni. A rendszerben bármely érdekes DNS-szekvencia programozható és megcélozható.
A mikrobák natív rendszerei általában egy exonukleázt – egy DNS-t hasító enzimet – visznek be a szekvenciába, feldarabolva a kórokozók genetikai anyagát. Ez a képesség felhasználható bármely kiválasztott DNS-szekvencia vágására a génszerkesztéshez; Enzimekkel és/vagy más DNS-szekvenciákkal kombinálva további rövid szekvenciák beillesztésére vagy törlésére, valamint mutáns gének korrekciójára használható. Egyes CRISPR-Cas rendszerek specifikus RNS-molekulákat vágnak le DNS helyett. Használhatók a betegséget okozó RNS, például egyes vírusok genomjainak eltávolítására, úgy, ahogyan a natív baktériumokban eliminálódnak. Ez az RNS-feldolgozás hibáinak megmentésére is használható.
A nukleinsavak módosításának azonban számos további módja van, amelyek hasznosak lehetnek. Nyitott kérdés, hogy fejlődtek-e olyan enzimek, amelyek további módosításokat hajtanak végre. Ezért néhány kutató úgy döntött, hogy megkeresi őket.
Az MIT kutatói új eszközt fejlesztettek ki a CRISPR tömbök variánsainak kimutatására, és 8,8 tera (1012) bázispárnyi prokarióta genomi információra alkalmazták. Az általuk talált rendszerek közül sok ritka, és csak az elmúlt 10 évben jelent meg az adathalmazban, rávilágítva arra, hogy mennyire fontos, hogy továbbra is olyan környezeti mintákat adjunk ezekhez az adattárakba, amelyeket korábban nehéz volt beszerezni.
Az új eszközre azért volt szükség, mert a fehérje- és nukleinsavszekvenciákat tartalmazó adatbázisok nevetséges ütemben bővülnek, így az összes adat elemzésére szolgáló technikák lépést tartanak. Az elemzésükhöz használt algoritmusok egy része megpróbálja összehasonlítani az egyes szekvenciákat minden más szekvenciával, ami nyilvánvalóan tarthatatlan, ha több milliárd génnel foglalkozunk. Mások a klaszterezésre támaszkodnak, de csak olyan géneket találnak, amelyek nagyon hasonlóak, így nem tudnak fényt deríteni a távoli rokon fehérjék közötti evolúciós kapcsolatokra. Ám a gyors, helyérzékeny hashtag-alapú klaszterezés („flash assembly”) úgy működik, hogy fehérjék milliárdjait csoportosítja kisebb és nagyobb szekvenciákba, amelyek csak kismértékben különböznek az új és ritka rokonok azonosításához.
Az FLSHclust használatával végzett keresés 188 új CRISPR-Cas rendszert hozott létre.
Sok CRISPyness
Néhány téma kirajzolódott a műből. Az egyik az, hogy néhány újonnan azonosított CRISPR-rendszer Cas-enzimeket használ olyan doménekkel, amelyeket korábban soha nem láttak, vagy ismert génekkel való fúziónak tűnnek. A tudósok ezen enzimek egy részét is jellemezték, és azt találták, hogy az egyik specifikusabb, mint a jelenleg használt CRISPR enzimek, egy másik pedig az RNS-t vágja, amely szerintük szerkezetileg eléggé elkülönül ahhoz, hogy egy teljesen új, 7-es típusú CRISPR-Cas rendszert tartalmazzon.
Ennek a témának az a következménye, hogy a CRISPR-tömbökkel összekapcsolják a különböző funkciójú enzimeket, nem csak a nukleázokat (a DNS-t és az RNS-t hasító enzimeket). A tudósok kihasználták a CRISPR figyelemre méltó képességét a gének megcélzására azáltal, hogy más típusú enzimekhez és molekulákhoz kapcsolják, például fluoreszcens festékekhez. De nyilván az evolúció ért oda először.
Például az FLSHclust azonosított egy transzpozázt, amely két különböző típusú CRISPR rendszerhez kapcsolódik. A transzpozáz egy olyan enzim, amely segít a DNS egy meghatározott részének a genom egy másik részébe történő átvitelében. A CRISPR RNS által irányított transzformációt már korábban is láthattuk, de ez egy másik példa erre. Különböző funkciójú fehérjék egész sorát, például transzmembrán doménekkel és jelzőmolekulákkal rendelkező fehérjéket találtak a CRISPR tömbökhöz kapcsolódóan, ami rávilágít e rendszerek fejlődésének keveredő jellegére. Még egy vírus által expresszált fehérjét is találtak, amely a CRISPR tömbökhöz kötődik, és inaktívvá teszi azokat, a vírus lényegében letiltja a vírusok elleni védelemre kifejlesztett CRISPR rendszert.
A kutatók nemcsak a CRISPR-tömbökhöz kapcsolódó új fehérjéket találtak, hanem más, szabályosan elhelyezett ismétlődő tömböket is, amelyek nem kapcsolódnak egyetlen Cas enzimhez sem, hasonlóan a CRISPR-hez, de nem a CRISPR-hez. Nem biztosak ezeknek az RNS-vezérelt rendszereknek a működésében, de feltételezik, hogy ugyanúgy részt vesznek a védekezésben, mint a CRISPR.
A szerzők arra törekedtek, hogy megtalálják az RNS által irányított fehérjék listáját, amelyek bővítik ismereteinket e rendszerek biológiájáról és evolúciójáról, és kiindulópontot adnak új biotechnológiák kifejlesztéséhez. És úgy tűnik, elérték céljukat: „E munka eredményei a CRISPR-rendszerek példátlan szabályozási és funkcionális rugalmasságáról és modularitásáról tanúskodnak” – írják.Kifejezik: „Ez a felfedezett rendszereknek csak egy kis töredékét képviseli, de rávilágít a Föld biodiverzitásában rejlő kiaknázatlan lehetőségek széles skálájára.” , a Föld biodiverzitása, a fennmaradó jelöltek pedig erőforrásként szolgálnak majd a jövőbeli kutatásokhoz.
Cikk DOI: 10.1126/science.adi1910

„Utazási specialista. Tipikus közösségi média tudós. Az állatok barátja mindenhol. Szabadúszó zombinindzsa. Twitter-barát.”





More Stories
A SpaceX Polaris Dawn űrszondájának legénysége a valaha volt legveszélyesebb űrsétára készül
Egy őskori tengeri tehenet evett meg egy krokodil és egy cápa a kövületek szerint
Egyforma dinoszaurusz-lábnyomokat fedeztek fel két kontinensen